co2h2合成汽油_二氧化碳人工合成汽油项目
1.co h2 能合成什么
2.据报道:美国海军科学家拟提取海水中溶解的二氧化碳,利用类似FT合成的方法生产短链不饱和烃,以作为汽油
3.甲烷的性质什么
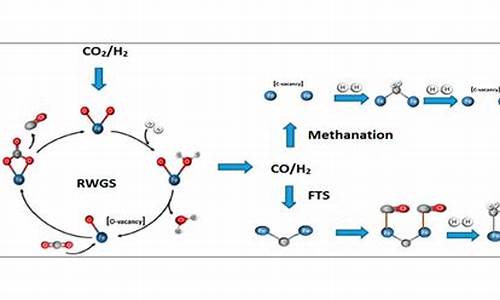
煤的间接液化技术是先将煤全部气化成合成气,然后以煤基合成气(一氧化碳和氢气)为原料,在一定温度和压力下,将其催化合成为烃类燃料油及化工原料和产品的工艺,包括煤炭气化制取合成气、气体净化与交换、催化合成烃类产品以及产品分离和改制加工等过程。 1923年,德国化学家首先开发出了煤炭间接液化技术。40年代初,为了满足战争的需要,德国曾建成9个间接液化厂。二战以后,同样由于廉价石油和天然气的开发,上述工厂相继关闭和改作它用。之后,随着铁系化合物类催化剂的研制成功、新型反应器的开发和应用,煤间接液化技术不断进步,但由于煤炭间接液化工艺复杂,初期投资大,成本高,因此除南非之外,其它国家对煤炭间接液化的兴趣相对于直接液化来说逐渐淡弱。
煤炭间接液化技术主要有三种,即的南非的萨索尔(Sasol)费托合成法、美国的Mobil甲醇制汽油法和正在开发的直接合成法。煤间接液化技术在国外已实现商业化生产,全世界共有3家商业生产厂正在运行,它们分别是南非的萨索尔公司和新西兰、马来西亚的煤炭间接液化厂。新西兰煤炭间接液化厂用的是Mobil液化工艺,但只进行间接液化的第一步反应,即利用天然气或煤气化合成气生产甲醇,而没有进一步以甲醇为原料生产燃料油和其它化工产品,生产能力1.25万桶/天。马来西亚煤炭间接液化厂所用的液化工艺和南非萨索尔公司相似,但不同的是它以天然气为原料来生产优质柴油和煤油,生产能力为50万吨/年。因此,从严格意义上说,南非萨索尔公司是世界上唯一的煤炭间接液化商业化生产企业。
南非萨索尔公司成立于50年代初,1955年公司建成第一座由煤生产燃料油的Sasol-1厂。70年代石油危机后,1980年和1982年又相继建成Sasol-2厂和Sasol-3厂。3个煤炭间接液化厂年加工原煤约4600万t,产品总量达768万t,主要生产汽油、柴油、蜡、氨、乙烯、丙烯、聚合物、醇、醛等113种产品,其中油品占60%,化工产品占40%。该公司生产的汽油和柴油可满足南非28%的需求量,其煤炭间接液化技术处于世界领先地位。
此外,美国SGI公司于80年代末开发出了一种新的煤炭液化技术,即LFC(煤提油)技术。该技术是利用低温干馏技术,从次烟煤或褐煤等非炼焦煤中提取固态的高品质洁净煤和液态可燃油。美国SGI公司于1992年建成了一座日处理能力为1000t的次烟煤商业示范厂。 费托合成(Fisher-Tropsch Sythesis)合成是指CO在固体催化剂作用下非骏相氢化生成不同链长的烃类(C1~C25)和含氧化合物的反应。该反应于1923年由F.Fischer和H.Tropsch首次发现后经Fischer等人完善,并于1936年在鲁尔化学公司实现工业化,费托(F-T)合成因此而得名。
费托合成反应化学计量式因催化剂的不同和操作条件的差异将导致较大差别,但可用以下两个基本反应式描述。
(1)烃类生成反应
CO+2H2→(-CH2-)+H2O
(2)水气变换反应
CO+ H2O→H2+ CO2
由以上两式可得合成反应的通用式:
2CO+H2→(-CH2-)+ CO2
由以上两式可以推出烷烃和烯烃生成的通用计量式如下:
(3)烷烃生成反应
nCO+(2n+1)H2→CnH2n+2+nH2O
2nCO+(n+1)H2→CnH2n+2+nCO2
3nCO+(n+1)H2O→CnH2n+2+(2n+1)CO2
nCO2+(3n+1)H2→CnH2n+2+2nH2O
(4)烯烃生成反应
nCO+2nH2→CnH2n+nH2O
2nCO+nH2→CnH2n+nCO2
3nCO+nH2O→CnH2n+2nCO2
nCO2+3nH2→CnH2n+2nH2O
间接液化的主要反应就是上面的反应,由于反应条件的不同,还有甲烷生成反应,醇类生成反应(生产甲醇就需要此反应),醛类生成反应等等。 煤间接液化可分为高温合成与低温合成两类工艺。高温合成得到的主要产品有石脑油、丙烯、α-烯烃和C14~C18烷烃等,这些产品可以用作生产石化替代产品的原料,如石脑油馏分制取乙烯、α-烯烃制取高级洗涤剂等,也可以加工成汽油、柴油等优质发动机燃料。低温合成的主要产品是柴油、航空煤油、蜡和LPG等。煤间接液化制得的柴油十六烷值可高达70,是优质的柴油调兑产品。
煤间接液化制油工艺主要有Sasol工艺、Shell的SMDS工艺、Syntroleum技术、Exxon的C-21技术、Rentech技术。己工业化的有南非的Sasol的浆态床、流化床、固定床工艺和Shell的固定床工艺。国际上南非Sasol和Shell马来西亚合成油工厂已有长期运行经验。
典型煤基F-T合成工艺包括:煤的气化及煤气净化、变换和脱碳;F-T合成反应;油品加工等3个纯“串联”步骤。气化装置产出的粗煤气经除尘、冷却得到净煤气,净煤气经CO宽温耐硫变换和酸性气体(包括H2和CO2等)脱除,得到成分合格的合成气。合成气进入合成反应器,在一定温度、压力及催化剂作用下,H2S和CO转化为直链烃类、水以及少量的含氧有机化合物。生成物经三相分离,水相去提取醇、酮、醛等化学品;油相用常规石油炼制手段(如常、减压蒸馏),根据需要切割出产品馏份,经进一步加工(如加氢精制、临氢降凝、催化重整、加氢裂化等工艺)得到合格的油品或中间产品;气相经冷冻分离及烯烃转化处理得到LPG、聚合级丙烯、聚合级乙烯及中热值燃料气。 (1)合成条件较温和,无论是固定床、流化床还是浆态床,反应温度均低于350℃,反应压力2.0-3.0MPa;
(2)转化率高,如SASOL公司SAS工艺用熔铁催化剂,合成气的一次通过转化率达到60%以上,循环比为2.0时,总转化率即达90%左右。Shell公司的SMDS工艺用钴基催化剂,转化率甚至更高;
(3)受合成过程链增长转化机理的限制,目标产品的选择性相对较低,合成副产物较多,正构链烃的范围可从C1至C100;随合成温度的降低,重烃类(如蜡油)产量增大,轻烃类(如CH4、C2H4、C2H6、……等)产量减少;
(4)有效产物-CH2-的理论收率低,仅为43.75%,工艺废水的理论产量却高达56.25%;
(5)煤消耗量大,一般情况下,约5~7t原煤产1t成品油。
(6)反应物均为气相,设备体积庞大,投资高,运行费用高;
(7)煤基间接液化全部依赖于煤的气化,没有大规模气化便没有煤基间接液化。 我国从50年代初即开始进行煤炭间接液化技术的研究,曾在锦州进行过4500t/年的煤间接液化试验,后因发现大庆油田而中止。由于70年代的两次石油危机,以及“富煤少油”的能源结构带来的一系列问题,我国自80年代初又恢复对煤间接液化合成汽油技术的研究,由中科院山西煤化所组织实施。
“七五”期间,山西煤化所开的煤基合成汽油技术被列为国家重点科技攻关项目。1989年在代县化肥厂完成了小型实验。“八五”期间,国家和山西省投资2000多万元,在晋城化肥厂建立了年产2000吨汽油的工业试验装置,生产出了90号汽油。在此基础上,提出了年产10万吨合成汽油装置的技术方案。2001年,国家863和中科院联合启动了“煤变油”重大科技项目。中科院山西煤化所承担了这一项目的研究,科技部投入资金6000万,省投入1000万和本地企业的支持,经过一年多攻关,千吨级浆态床中试平台在2002年9月实现了第一次试运转,并合成出第一批粗油品,低温浆态合成油可以获得约70%的柴油,十六烷值达到70以上,其它产品有LPG(约5%~10%)、含氧化合物等。其核心技术费托合成的催化剂、反应器和工艺工程也取得重大突破。
万吨级煤基合成汽油工艺技术软件开发和集成的研究正在进行,从90年代初开始研究用于合成柴油的钴基催化剂技术也正处在试验阶段。经过20年的开发和研究,目前我国已经具备建设万吨级规模生产装置的技术储备,在关键技术、催化剂的研究开发方面已拥有了自主知识产权。可以这样讲,我国自己研发的煤炭液化技术已达到世界先进水平。中科院山西煤化所与连顺能源有限公司就共同组建合成油品实验室达成协议,连顺公司为山西煤化所技术研究和开发出资1500万元,用于关键技术的研究和有关技术的开发,并最终用3-5年时间在山西朔州建一个年产15万t合成液化油的间接液化生产厂。中科院和山西省签署了“发展山西煤间接液化合成油产业的框架协议”,根据这个协议,在今后5-10年内,山西省将以自己的煤炭优势为依托,借助产业化部门的加盟,通过国家投资和社会融资方式,在朔州和大同几个大煤田之间建成一个以百万吨煤基合成油为核心的、多联产特大型企业集团。
在技术开发的同时,国内煤炭企业对引进成熟技术、建设煤间接液化工厂做了大量工作。平顶山煤业集团、宁夏煤业集团以及神华集团就建设间接液化商业化示范工厂进行了煤种评价试验和建厂预可行性研究,并就引进技术、投融资、立项等做了大量前期工作,项目正在论证阶段。
co h2 能合成什么
(1)已知:①2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H=-256.1kJ?mol-1;
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ?mol-1,
利用盖斯定律,将①-②×2可得2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=(-256.1kJ?mol-1)-2×(-41.2kJ?mol-1)=-173.7kJ?mol-1,
故答案为:-173.7kJ?mol-1;
(2)①升高温度,发现NO的分解率降低,说明反应向逆反应方向进行,该反应放热;由图可知,在
| n(NO) |
| n(CO) |
故答案为:该反应是放热反应,升高温度反应更有利于向逆反应方向进行;900℃;
②Ⅰ.υ(NO)=
| 1mol/L?0.4mol/L |
| 20min |
| 0.30×0.30 |
| 0.402 |
故答案为:0.030mol/(L?min);0.75;
Ⅱ.由表中数据可知,30min后,NO的浓度较低,N2浓度增大,说明平衡向正反应方向移动,而CO2的浓度减小,应为分离出CO2的缘故,
由于CO2浓度减小,则逆反应速率降低,图象为,故答案为:减小CO2的浓度;.
据报道:美国海军科学家拟提取海水中溶解的二氧化碳,利用类似FT合成的方法生产短链不饱和烃,以作为汽油
一氧化碳与氢气(就是合成气)可以不经过甲醇和二甲醚一步法合成汽油,可以在在Rh-Mn-Li/SiO2催化剂上合成甲醇、乙醇等低碳醇,可以合成二甲醚,还能合成醋酸。
此外还有其余C1系列产品,如甲醛、甲酸等。
甲烷的性质什么
(1)abd为化合反应原子利用率是100%,故答案为:abd;
(2)(a)用太阳能光解海水制氢无二氧化碳生成;
(b)利用天然气与水高温催化制氢有二氧化碳生成;
(c)制取活泼金属时消耗能量,可能有二氧化碳生成;
(d)利用核反应堆多余的电能电解海水制氢无二氧化碳生成;
故答案为:ad;
(3)反应物是CO2与H2,反应的化学方程式为8CO2+20H2
| 催化剂 |
| 催化剂 |
(4))①CO2和H2转化为丁烷或者戊烷时分别求得n(H2)/n(CO2)为3.2和3.25,故a取值范围为3.2<a<3.25,故答案为:3.2<a<3.25;
②CO2448L合20摩尔,设生成戊烷K摩尔则生成丁烷Kx摩尔,从C原子守恒知:
5K+4Kx=20…(1)
再根据H和O元素守恒分别可得到:H2O为40摩尔,其中H为80摩尔,丁烷和戊烷中总的H原子为10Kx+12K摩尔,则2=80+10Kx+12K…(2)
由(1)(2)解得y=
| 260x+320 |
| 4x+5 |
| 260x+320 |
| 4x+5 |
. 甲烷的化学式、性质和用途
2. 甲烷的化学性质,取代反应的概念
教学难点:
甲烷的结构和甲烷的化学性质
教学设备:
甲烷的分子结构模型(球棍模型和比例模型);化学试验仪器;多媒体教学设备。
教学过程:
引言:
从今天起,我们将学习有机化合物的知识。有机化合物与人类的生活有密切的关系,在衣、食、住、行、医疗、能源、材料、科学技术及工农业生产等领域中都起着重要作用。
在有机化学中我们将学习烃、烃的衍生物、糖类、油脂、蛋白质及合成材料等。
最早,人类只能从动植物体中取得一些有机物。后来,人类能通过非动植物体制取有机物。如今,人类不但可以合成自然界里已有的许多有机物,而且还能合成出自然界里原来没有的多种多样性能良好的有机物。
因二氧化碳、一氧化碳、碳酸盐及碳酸氢盐等具有无机化合物的性质,除二氧化碳、一氧化碳、碳酸盐及碳酸氢盐外,绝大多数含碳的化合物都是有机化合物。
目前,人类从自然界发现和人工合成的有机物已经超过二千万种,这个数字已远远超过无机化合物。
有机化合物种类和数目繁多的主要原因是碳原子的结构所决定的.
一、甲烷的组成和结构
根据我们所学知识,请一位同学上来画出碳原子和氢原子的结构示意图
已知甲烷是仅由碳、氢两种元素组成,且甲烷是最简单的烃。你能否从碳氢原子的结构分析并推出甲烷的分子式吗?允许小组讨论(学生积极思考问题,教师找一个学生总结讨论结果。)
因为碳原子最外层有4个电子,欲形成8电子稳定结构,需要形成4对共用电子对才能达到8个电子的稳定结构;氢原子核外有1个电子,欲形成2个电子的稳定结构,需要形成1对共用电子对才能达到2个电子的稳定结构,所以甲烷的分子式为CH4。
那么甲烷的电子式怎样书写?(由1个学生板演,其余学生在下面练习。)
这种用短线来表示一对共用电子的图式叫结构式。
那么甲烷分子中的原子在空间是如何分布的呢?(学生讨论)
学生小组讨论:讨论结果是可能有两种结构──平面正方形结构和正四面体结构。
教师活动:究竟甲烷的空间结构是怎样的呢?
(实物展示:甲烷分子的球棍模型和比例模型。)
(学生相互传看两种模型,同时相互之间对自己课前制作的甲烷模型〔参照教材上的“实践活动”栏目或用橡皮泥、木棒等代用品制作的简易模型〕进行评价,在活动中加深对甲烷空间结构的认识。)
陈述和板书:经过科学实验证明甲烷分子的结构是正四面体结构,碳原子位于正四面体的中心,4个氢原子分别位于正四面体的4个顶点上(键角109°28′)。
甲烷的性质
物理性质:甲烷是无色、无臭的气体,密度是0.717g/L(标准状况),极难溶于水。
甲烷是池沼底部产生的沼气和煤矿的坑道所产生的气体的主要成分。这些甲烷都是在隔绝空气的情况下,由植物残体经过微生物发酵的作用而生成的。
有些地方的地下深处蕴藏着大量叫做天然气的可燃气体,它的主要成分也是甲烷,按体积计算,天然气中一般约含有甲烷80%——%。
通常情况下,甲烷稳定,如与强酸、强碱和强氧化剂等一般不发生化学反应。在特定条件下甲烷能与某些物质发生化学反应,如可以燃烧和发生取代反应等。
1.甲烷的氧化反应
[实验]点燃甲烷,燃烧,火焰呈淡蓝色。分别用干燥的小烧杯和沾有澄清石灰水的小烧杯罩在火焰上,可以发现干燥的小烧杯内有无色液体生成,沾有澄清石灰水的小烧杯罩石灰水变浑浊。
CH4+2O2 CO2+2H2O
[实验]把甲烷通入盛有酸性高锰酸钾溶液中,观察紫色的高锰酸钾溶液是否褪色?
从实验中可知溶液颜色没有变化,说明甲烷与高锰酸钾不发生反应。
2.甲烷的取代反应
[实验]取一个100mL的量筒,用排饱和食盐水的方法收集20mLCH4和Cl2,放在光亮的地方,日光不要直射,等待片刻,观察发生的现象。
[由现象讨论后得出结论]
现象:量筒壁上出现油滴,量筒内的液面上升,气体颜色略浅。
结论:(学生观看甲烷与氯气发生取代反应的教学软件)
甲烷分子里的氢原子是被氯原子逐步取代的,共生成五种物质,四种取代产物。
有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应叫做取代反应。
在常温下,一氯甲烷是气体,二氯甲烷、三氯甲烷和四氯甲烷是液体,其中四氯甲烷又叫四氯化碳,三氯甲烷又叫氯仿,三氯甲烷和四氯甲烷是工业上重要的溶剂。
3.甲烷的受热分解
在隔绝空气的情况下,加热至10000C,甲烷分解生成炭黑和氢气。
CH4 C + 2H2
氢气是合成氨和合成汽油等工业的原料;炭黑是橡胶和染料的工业原料。
总结:同学们,我们今天学习了有机物的概念以及甲烷的结构,性质,用途等,重点是要掌握甲烷的结构性之间的关系以及取代反应这一全新的反应,通过这一节课的学习,相信大家对有机物以及其学习方法都有了一定的认识,对于今后学习有机物奠定了基础,而且我们也了解了天然气是一种洁净的燃料,会在今后更广泛地应用,取代那些已产生环境污染的燃料,同时它也是极易燃烧爆炸的,所以一定要注意其在生产生活中的安全操作。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。